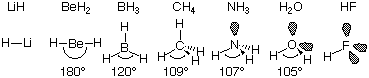
| このページは、2019年3月に保存されたアーカイブです。最新の内容ではない場合がありますのでご注意ください |
<分子の形を決めるもの>
分子の形を決める要因はいろいろあるが、
結合電子対
や
非結合電子対
の反発はそのひとつとして重要である。LiからFまでの第2周期元素7種の水素化物に例をとると、結合電子しかもたない水素化ベリリウム(BeH2)や水素化ホウ素(BH3)*は平面状なのに対し、非結合電子をもつアンモニア(NH3)や水(H2O)は立体的である。BeH2では結合電子対間の反発のみによって2本のH-Be結合は180度反対を向き、同様にBH3では3本のB-H結合は平面3方向(120度)に向いている。それに対し、アンモニアは非共有電子対との反発でH-N-H
結合角
は107度、同様に水のH-O-H結合角は105度となる。
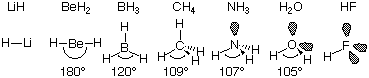
メタン、アンモニア、水の結合角がこの順に小さくなっているのは、非結合電子は結合電子に比べてより中心原子に引きつけられているため、結合電子対同士の反発よりも結合電子対と非結合電子対との反発の方が大きいためである。
*水素化ホウ素は通常は2分子会合して二量体分子(B2H6)をつくっている。その構造は コラム1 を参照。
| このページは、2019年3月に保存されたアーカイブです。最新の内容ではない場合がありますのでご注意ください |